新藥研發是一條漫長而昂貴的過程,新開發藥物通過所有臨床試驗、成功上市的機率非常低。製藥業與其他產業最大的不同,就是它昂貴的研發費用以及耗時的研製程序,然而一旦有產品成功上市,報酬率相當驚人!藥品的上市必須經過複雜冗長的藥物探索期、動物試驗、臨床試驗和主管單位核准的過程,平均費時十年以上,所耗資金高達150~200億台幣!

行政院於2009年提出『生技起飛鑽石行動方案』的發展策略,已促成設立食品藥物管理局 (FDA),著手建置與國際銜接的法規環境,加入PIC/S GMP國際品質組織,強化國內生技醫藥研發單位。我國政府對生技醫藥之研發投資不小,尤其國科會、經濟部、衛生署都有補助藥物研發計畫之經費,因次新藥研發是我國生物科技產業未來的發展重點!
早期我國在新藥開發的研發以學名藥的製程研究為主,針對佔有一定市場,且專利過期或即將到期的藥物進行製程改良及開發,近年來,則投入中草藥、小分子藥品,以及生技藥品的開發。本篇將簡單介紹新藥的研發過程,使讀者有一個整體概念。
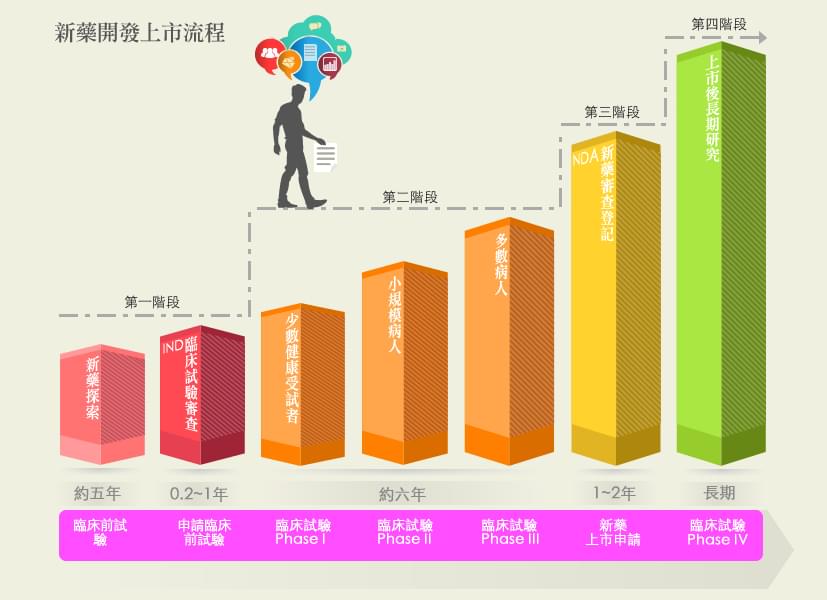
臨床前試驗(Pre-clinical toxicological tests)
藥物進入人體臨床前於動物模型中測試有效性和安全性;意即使動物得到和人類相同的疾病,例如糖尿病或各種癌症,來測試藥品的效果及動物中吸收、分布、代謝等情形。藥物最終目的是要在病人身上證明有效,但為了安全起見,一定要先在動物身上證明其具有藥效,並且安全,這是必要的實驗過程。完成初步的有效性和安全性的瞭解,才能向衛生主管機構申請「試驗用新藥」(investigational new drug, IND)。
臨床試驗(Clinical trials)
新藥研發的目標是生產安全、有效的藥物。臨床試驗在此過程中扮演一個關鍵的步驟,即在藥品獲得核准前進行嚴格的系統性測試,將試驗用藥施於病人或健康的受試者,以評估藥物的療效及是否能應用於廣泛的族群。臨床試驗的執行都應該在衛生主管機關核可之醫學中心或醫院執行,而且必須經過人體試驗倫理委員會(Institutional Review Board, IRB)之同意,以保障人體試驗的品質符合優良臨床試驗規範(Good Clinical Practice, GCP)。
人體試驗倫理委員會(IRB)由執行臨床試驗的機構自行聘任的醫療專業人員、法律專家、社會工作人員及其他社會公正人士組成,且報請中央主管機關備查。主要目的是保障受試者的安全及人權,確定受試者皆是經由理性思考後志願參與,且被詳細告知所有的風險與權益。此委員會的運作亦有利人體試驗計劃書審查之效率。
新藥的臨床試驗通常分成一至四期,其中一至三期是上市前申請「新藥查驗登記」(New drug application, NDA)所需。為了試驗的可信度,利用統計科學來嚴謹評估其臨床療效與安全性。
臨床試驗研究為了透明化,不隱藏負面結果,在國際醫學雜誌編輯委員會投稿的試驗皆須登錄其試驗於公開的網站:http://clinicaltrials.gov/ ,讀者若有興趣可自由查詢。

目的是為了了解藥品在人體內的吸收、分佈、代謝等情形,以及確定人體對該藥品能忍受的劑量範圍。實驗方法是把在動物實驗中測得的最大安全劑量測試於健康人體,以了解人體耐受度,並詳細紀錄副作用。此階段通常在醫院或特定的臨床試驗機構(CRO)中,經由有經驗的醫師來執行,以便密切監測受試者的安全。

此階段會決定出最佳劑量、用法和給藥間隔,評估不同劑量對病人之有效性與安全性,根據該試驗結果來設計第三期臨床試驗(phaseⅢ)的受試者人數。一般來說,第二期臨床試驗是最不容易成功的,從臨床二期進入臨床三期是新藥開發的關鍵!但有些藥品 (例如:治療愛滋病的藥物或是治療罕見疾病的藥品等) 也是有可能會直接從第一期臨床試驗(phaseⅠ)跳到第三期臨床試驗(phase Ⅲ),以加快上市腳步。

主要研究設計為大型、隨機、對照的試驗,可能於跨國或多個醫學中心執行。確認新藥所有可能產生的副作用、長期使用的效果及影響,以及市場上相近產品的比較。若新藥合乎上市許可之法規,即可向藥品管理機構(FDA)申請新藥查驗登記(NDA,New Drug Application)。在美國,要取得新藥申請(NDA),一般需要兩個獨立的第三期臨床試驗研究,才可能被批准通過。

在這段期間,藥廠可能會擴大生產線並且繼續研究一些新的適應症或複方製劑來延長其專利有效期,以及將適用對象擴及到不同族群之研究,例如兒童。 此階段是藥品上市後的追蹤,監測該藥物是否有先前幾個階段沒發現的副作用或是不良反應等情況,試驗設計較為簡單,但是需要大量的病人進行長時間的觀察。
新藥查驗登記NDA (New Drug Application)
FDA 審核NDA 的時間最少花上兩個月,若FDA 認為需要其他資料補充,或需補行額外的試驗,則可能花上長達七年的時間。如果新藥屬於AIDS、癌症等重要且迫切需求的藥品,便可列為優先審查,縮短審核的時間。詳細介紹於下篇文章《新藥查驗登記》。









20年來年化報酬率-17%-科林·麥克萊恩的投資原則-_-.png)





