“寶齡富錦(1760-TW)生技旗下腎病新藥「拿百磷」(Nephoxil),獲衛生福利部食品藥物管理署(TFDA)審核通過,核定為控制接受血液透析治療的成年慢性腎病患者的高血磷症新藥。”104-01-16 經濟日報/記者黃文奇/台北報導
台灣生技公司寶齡富錦近來是紅到不能再紅的當紅炸子雞,旗下的腎病新藥:拿百磷 ( Nephoxil)已分別拿下日本、美國和台灣新藥藥證,並已開始回收日本地區的銷售權利金。這是十年難得一件的新藥大事,寶齡富錦已著實成為台灣之光!
新藥開發產業
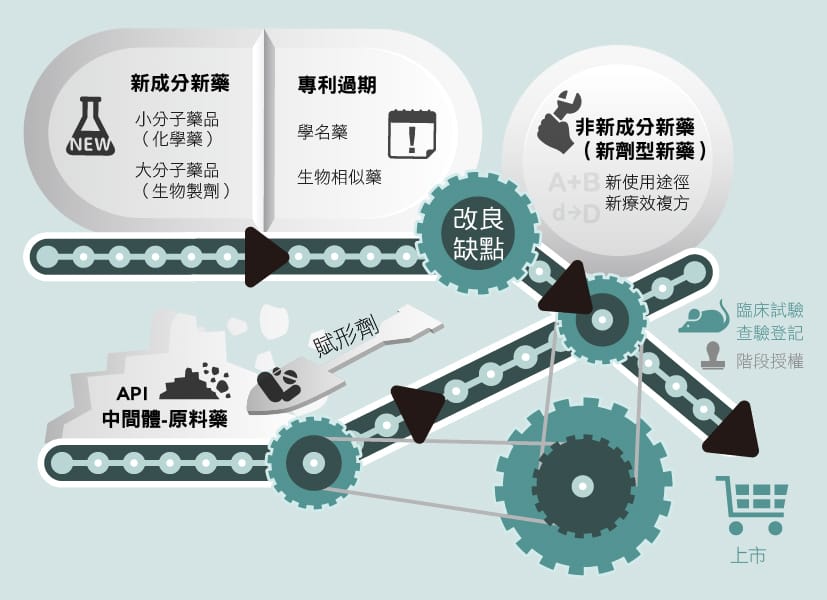
送到患者手中的藥物,是一步一步經過嚴謹的製程,將原料藥再加入賦形劑變成一般所知、可使用的藥品,這些藥品經由臨床試驗證明其有效性及安全性後,拿到政府核發的許可證接著就能在市場上販售。
在新藥開發市場中,難度最高挑戰也最大的是新成分新藥(New Chemical Entity,簡稱NCE),要完全從無到有,其中需要投入巨額資金和十幾年以上的時間。近幾年藥廠耗費在新成分新藥的開發成本提高,然而成功上市的數目卻沒有相對增加,因此另一條新藥開發的捷徑:新劑型新藥,就展現其價值所在。
新劑型新藥,也就是非新成分新藥,是將已上市的藥品再經過改良,有可能是改善療效、降低副作用、由單方變成複方、或是調整使用方式等,簡單而言即是「老藥新用」,將既有藥品重新定位,讓其再次出發。因為安全性資料已經過驗證,於臨床試驗申請IND(Investigational New Drugs)和新藥查驗登記NDA(New Drug Application)階段時審核標準較不像新成分新藥一樣嚴格。
過往,台廠受限於市場和技術因素,在較低價、低技術門檻的學名藥市場競爭廝殺,而十年前政府開始培植生技人才,也祭出多個政策鼓勵企業發展,近幾年台廠逐漸在國際間嶄露頭角,有些開發特殊學名藥或新劑型新藥、也有些野心更大的廠商,想要創造出一個完全「Made in Taiwan」的新藥。寶齡就是在萬眾期待下,向全球展示他們的成果─新藥NephoxilR。
寶齡在產業中的商機
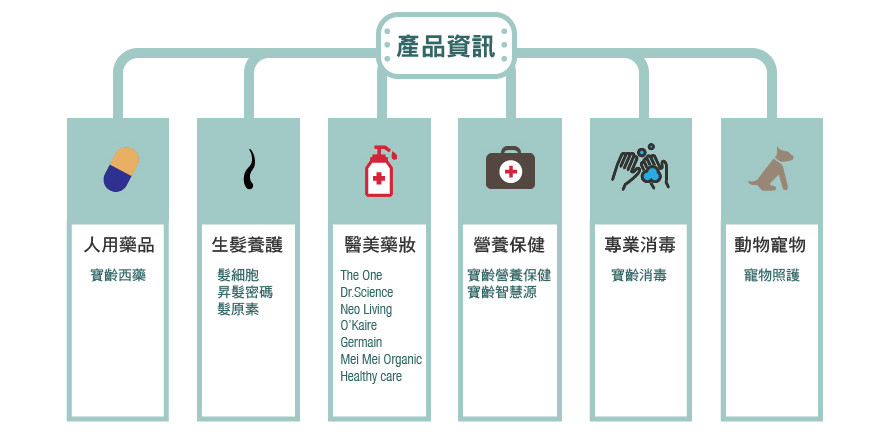
其相關事業體含括了西藥品、醫美藥妝、營養保健、感染控制(清潔消毒)及動物系列等,產品線完整,並持續引進新技術、深耕研發實力,積極佈局國內外市場。
寶齡為突破傳統學名藥廠瓶頸、積極尋求藥業發展新藍海,自2001年起投入全球專利新藥開發,首例指標新藥NephoxilR為治療慢性腎臟病患者好發之高血磷症,十餘年間堅持以國際規格於臨床、法規、製程、專利及商業化等各面向進行同步開發,目前本指標新藥已分別於103年1月、9月及104年1月取得日本、美國及台灣新藥上市許可,歐洲則已進入藥證審查階段,成果可期。
新藥-拿百磷Nephoxil®
其主成分為藥用級檸檬酸鐵,屬於新一代不含鈣、鋁及重金屬的鐵型磷結合劑,專為治療慢性腎臟病或洗腎患者最常發生的併發症『高磷酸血症』 (hyperphosphatemia) 所研發,是全球目前唯一一種得以同步治療腎病病患高血磷症與貧血的腎臟新藥。拿百磷在全球共具有52國、29個專利,專利期限可延展至2024年以後,已准許上市的美國市場,產品名為Auryxia®,日本則名為Riona®。
未來將與中國大陸的威高藥業公司合作,並借助威高集團在腎臟病領域之豐富經驗與廣大的通路平台,將新藥拿百磷與其他產品引進大陸,並著手進行寶齡旗下腎病新藥「Nephoxil拿百磷」於中國市場之註冊、進口、生產及銷售等事宜。
Nephoxil®開發授權流程:
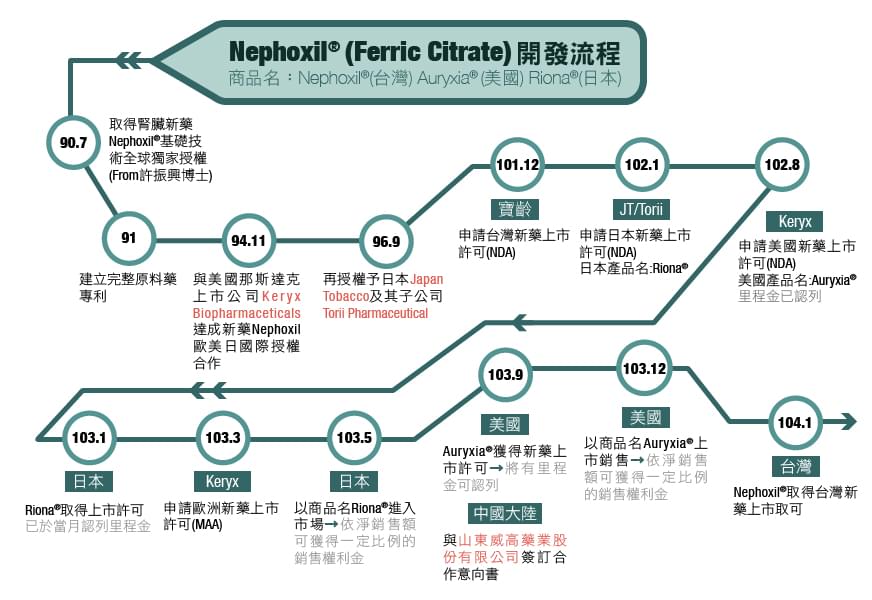
重要授權合約依公開資訊觀測站公告整理如下:
I. 103/9/1與山東威高藥業股份有限公司簽訂合作意向書
(1)本公司與威高藥業簽訂合作意向書,雙方就成立合資公司、實現專利腎病新藥Nephoxil(R)拿百磷(R)(以下簡稱Nephoxil)於中國大陸之進口註冊、銷售及生產事宜達成意向,並將依合作意向書為基礎制定正式合約。
(2)雙方擬成立合資公司,本公司將Nephoxil專利技術授權予該合資公司,並以部分里 程金轉投資合資公司股權取得占股49%,威高藥業另出資占股51%。
(3)合資公司成立後,雙方將以合資公司為主體,負責Nephoxil於中國大陸之進口註冊、銷售及生產事宜。
(4)本公司將依Nephoxil在中國大陸之開發進度,向合資公司收取簽約金及里程金等 總金額計人民幣1.5億元。
(5) 對公司財務、業務之影響(解除者不適用): 本公司將依Nephoxil在中國大陸之開發進度,向合資公司收取簽約金及里程金,且本公司未來將依對合資公司持股比例認列投資損益
II. 與Keryx授權合約內容
Keryx將依產品開發進度支付本公司里程金、產品銷售權利金,謹補充說明如下。
(1)銷售權利金(Royalty):
被授權人(Keryx)應支付或使其再授權之被授權人支付權利金予授權人(寶齡),權利金依其各自市場之淨銷售額乘與一定比率計算之。
淨銷售額之定義:授權產品之銷售總額(亦即發票金額,但不含公司內部間專屬移轉或買賣),減去合理之銷售扣除額 (包含產品毀損、折扣、運費、服務費、保險…..等)
(2)進度達成里程金(Milestone Payment):
依合約約定里程金之支付時程及目前開發進度如下:
A.授權產品向美國FDA進行第一次申請新藥上市:102/08(NDA)後120天內支付102年年報已認列。
B.授權產品取得美國FDA第一次上市許可:尚未達成
C.授權產品取得歐洲任一國家第一次上市許可:尚未達成
D.授權產品取得日本第一次上市許可:103/01(marketing approval)後120天內支付。
III. 依主管機關要求本公司補充揭露腎臟新藥Nephoxil與許振興博士簽訂專利授權相關資訊。
本公司於民國90年7月24日(民國94年8月29日簽訂增補條款)與許振興博士簽訂專利授權合約,取得腎臟新藥Nephoxil專利授權,相關支付義務條件概述如下:
(1)簽約金:US$350仟元。(已於91年9月支付許振興博士)
(2)若本公司有銷售該產品時: (目前尚無實際銷售)
A.產品銷售權利金:於產品上市銷售後依淨銷售額支付7.5%;授權專利過期後降低為2%。
B.產品上市銷售後每年最低應支付權利金:US$50仟元。
(3)若有經再授權人收取里程金或權利金時:
A.再授權之里程金:本公司自再授權對象取得之里程金須支付33.4%予許振興博士。(依據本公司與Keryx簽訂之授權合約,可依下列時點收取里程金(a)向美國FDA進行第一次申請新藥上市(NDA)許可(b)取得美國FDA第一次上市許可(c)取得歐洲任一國家第一次上市許可(d)取得日本第一次上市許可),第(a)項之里程金,本公司已於102年8月份認列營業收入,並己於10月份取得款項,另已於102年10月依前開比率支付予許振興博士。
B.再授權之權利金:產品上市銷售後,本公司自再授權對象取得之產品銷售權利金,須支付50%予許振興博士。(依據本公司與Keryx簽訂之授權合約,Keryx應依其銷售淨額給付本公司一定比率之權利金,本公司收取此權利金後,須支付50%予許振興博士,目前因無實際銷售,故無此款項之實際收取及支付)
(4)其他應敘明事項:
A.許振興博士有登記專利之國家包括:美國、加拿大、墨西哥、歐盟、挪威、以色列、日本、台灣、韓國及澳洲。
B.除上述國家外許振興博士並無專利權,自其他國家(如中國大陸等)取得之相關收益無需給付許振興博士。
未來公司發展策略
(一)以指標腎病新藥Nephoxil®為核心,與國際腎臟專科夥伴合作建立全球專業網絡,並持續發展腎臟科相關產品線組合,大幅提升新藥開發效益與國際市場競爭優勢。
(二)藉由外觀年齡與生理年齡全方位抗老化概念,積極發展醫美藥妝與營養保健品事業,除台灣市場多元通路經營外,並積極拓展中國大陸及國際市場佈局,其建立「寶齡抗老化中心」專業品牌概念連鎖效益,擴大經營績效。
(三)積極發展全系列感染控制產品線,已在台灣專業醫療通路建立品牌權威,並將應用範疇拓展至動物市場,後續將持續創新研發,全面發展生活環境感染控制之龐大需求,並推展至中國大陸及日本等海外市場。
(四)藉由內部核心團隊與研發育成平台,建立關鍵技術,發展體外感染檢測試劑及癌症診斷之技術與產品。
大事件
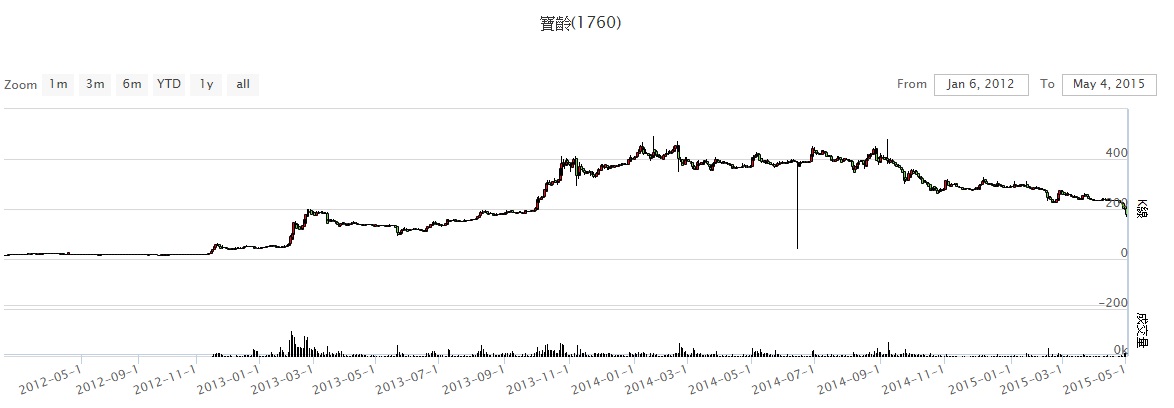
資料來源:股狗網
102/02/07
興櫃生技新藥廠寶齡因腎病新藥Nephoxil(R),受美國授權合作夥伴三期臨床數據傳佳音激勵,近期股價飆漲破百元,昨日封關以126.5元作收,上漲4.62元。該公司自結去年稅後仍虧損4,000萬元,稅後EPS虧損1.18元,寶齡新藥在台、日已申請NDA(新藥上市許可),後續在海外市場的里程金及新藥上市進度下,今年營運將成為市場關注焦點
102/03/02
生技族群近來股價火熱,尤其是興櫃生技漲勢更為驚人,已引起相關主管機關注意,近日已發函輔導券商,針對興櫃市場上漲幅過大、相關造勢活動提出說明,受此消息影響,興櫃生技股漲勢暫歇,包括安成、浩鼎(4174-TW)、寶齡、康富、泉盛同步出現回檔。
102/06/25
興櫃生技廠寶齡總經理江宗明昨(24)日表示,公司研發腎病新藥Nephoxil(拿百磷)台灣及日本已申請新藥上市(NDA),美國、歐洲今年底前也將送出,一旦上市成功,在里程碑金入帳後,有助今年轉虧為盈,並加快上市櫃腳步。
102/08/10
寶齡策略夥伴Keryx紐約時間8日宣布,新藥Zerenex正式向美國FDA遞件申請藥證(NDA),市場預期,寶齡將可因認列階段里程碑金,今年有機會虧轉盈。
102/10/25
生技股寶齡昨日股價續飆,日均價達336.87元,超越安成藥(4180)的335.27元,躍居興櫃股王,惟櫃買中心表示,寶齡股票近期股價大幅波動,本益比及股價淨值比均有異常情形,自今(25)日起十個營業日,單筆報價數量提高為1萬股。
102/11/02
美國生技類股重挫,台灣生技股跟著打哆嗦,美股除Merimack暴跌18.93%之外,包括Teva、Keryx等也都重挫;台股相關廠商智擎(4162-TW)、安成藥、寶齡等也殺聲震天,下周能否走出風暴備受矚目。
102/11/08
寶齡腎臟新藥 銷售權利金減半,昨(7)日公告,由於必須支付新藥發明人許振興權利金,未來Keryx藥廠每年支付給該公司的上市銷售權利金,其中50%歸許振興所有。
102/11/15
揭露不詳 櫃買重罰寶齡,櫃檯買賣中心昨(14)日發布新聞指出,興櫃市場寶齡富錦因有關研發腎病新藥所收取的里程金及權利金等資訊,從未詳實揭露,特別重罰40萬元。
103/01/18
台灣新藥前進國際由寶齡富錦搶得頭香!該公司昨日公告,已授權的腎臟病新藥「Nephoxil拿百磷 (日本產品名稱Riona)」,授權合作夥伴JT/Torii已順利取得日本厚生省的新藥上市許可,預計5/17日之前,寶齡將可獲階段里程金。
103/02/21
興櫃股王寶齡富錦開發的新藥「拿百磷」(Nephoxil),衛生福利部食品藥物管理署(TFDA)日前審查未過關,要求「補件再議」再審,衝擊昨(20)日股價,一開盤即大跌6.5%,並瞬間急殺至350元,重挫23.4%
103/05/24
寶齡 美藥證審決延後FDA審查結果延至9月公布 市場:利多遞延 不影響營運,國內新藥公司寶齡富錦昨(23)日表示,公司美國合作夥伴Keryx向美國食品藥物管理局(FDA)申請的腎病新藥Zerenex,藥證審決日期確定延後,將延至9月7日公布審查結果
103/09/02
寶齡腎病新藥Nephoxil規劃搶進大陸,該公司將今(2)日與中國大陸山東威高藥業簽訂合作意向書,雙方將成立合資公司,進行Nephoxil的新藥開發。寶齡預計可向合資公司收取簽約金及里程金約人民幣1.5億元。
103/09/07
寶齡授權夥伴Keryx於美東時間9月5日宣布,腎臟新藥Nephoxil(R)(拿百磷)(美國產品名稱為ZerenexTM)獲得美國FDA上市許可,該藥將在未來12個星期內上市,搶攻全球約15億美元市場。
104/01/16
寶齡已授權的腎臟病新藥拿百磷(Nephoxil)終於取得台灣食藥署(TFDA)藥證。拿百磷去年已拿到日本和美國藥證,法人預估該新藥全球商機約12億美元,去年日本銷售7個月,營業額約15.3億日幣(台幣近4千萬元)。
104/03/10
寶齡2月營收 大增79% 新藥銷日告捷 美權利金貢獻收入 今年EPS挑戰5元寶齡新藥,銷售起飛。寶齡富錦新藥銷日告捷,公司昨(9)日公告2月營收約8,100萬元,年增79.2%,今年加上日本與美國新藥權利金、原料藥權利金收入,為公司全年營運添柴火。 寶齡富錦抗腎病新藥已經在美國、日北上市
延伸閱讀:
- 「腎」利人生起飛 http://goo.gl/WVGpl4
- 當新藥產業遇上洗腎商機 http://goo.gl/VMZbrN
參考資料:
- 公開資訊觀測站
- 經濟日報
- 工商時報
- 寶齡富錦年報
§本網站個股介紹僅就公司在產業趨勢中的機會進行探討,以及部分年報、新聞的整理,真正的公司評價仍需從總體經濟、財務資訊或公司經營等全方面著手,本整理絕無任何明示或暗示之意,所提供資訊僅供參考,也無任何推介買賣之意,所有資訊仍應以資料來源公告為準。







電競硬體後進者_-.png)