傳統上我國對於新藥查驗登記的審查,均要求產品品質、安全與有效性的證明,但在審查時效上並沒有特殊規範與加速的流程。行政院於2009年提出『生技起飛鑽石行動方案』的發展策略,極力推行新藥審查機制改革,致力審查公開、透明、ㄧ致化,加強內部品質稽核,要全面提升藥品審查的品質與效率!藥物食品管理署 (TFDA)期望台灣在全球新藥發展能扮演更重要的角色,與國際一致的標準,加速新藥審查時效,期望新藥在台灣申請的時間能提早、或與全球同步。
目前建立的新藥審查機制有(1)一般新藥審查程序、(2)精簡審查程序、(3)優先審查機制、(4)加速核准機制,一般新藥審查程序平均工作天數約360天,如果符合優先、精簡、創新藥等要件,則有可能提前在200天內完成。
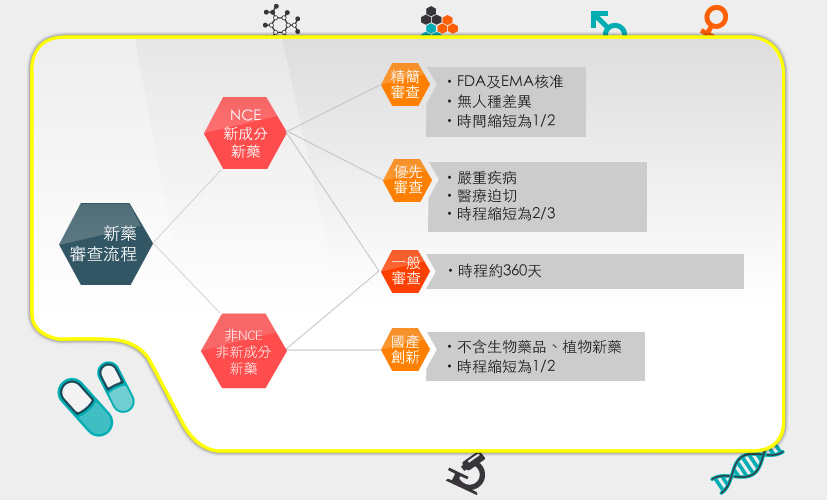
快速審查機制簡介
一、 優先審查機制
針對國人生命及健康維護有迫切需求的藥物所制定,適用對象為治療如癌症、愛滋病等嚴重疾病。目標為縮短審查時程為原限辦期限之2/3,使嚴重疾病的病患,早日使用到新藥,嘉惠病患。
二、 精簡審查機制
已獲美國食品藥物管理局 (FDA) 與歐盟醫藥品管理局 (EMA) 皆核准上市,但在國內屬於新成分新藥則適用此機制,縮短審查時程為原限辦期限之1/2。只要就新藥是否有人種差異性 (以銜接性試驗評估) 及上市風險管控,進行重點審查。
「銜接性試驗」為可提供與國人相關之藥動/藥效學或療效、安全、用法用量等臨床試驗數據,使國外臨床試驗數據能外推至本國相關族群之試驗,減少臨床試驗重複執行,以避免研發資源之浪費。
三、國產創新藥品快速審查機制
此方案為專案試辦,專案目的為希望加速國產新藥上市的速度已拓展外銷市場。適用於在國內製造或委託我國製造廠製造的新療效、新複方、新使用途徑、新劑型、新單位含量、或新使用劑量等藥品,不包括生物藥品、植物新藥及新成分新藥 (NCE)。製造廠須符合PIC/S GMP規範,縮短審查時程為原限辦期限之1/2。
四、加速審查作業(Accelerated approval)
對於病情嚴重、具生命威脅性、且缺乏充分治療方法之重大疾病,比如說:在十大醫藥先進國之任一國已取得罕見疾病用藥認定(Orphan drug designation)的藥物,TFDA允許加速審查。
在科學證據的支持下,選擇替代療效指標的方式 (先根據較小規模的臨床研究中的藥效指標,來預期後續藥物之臨床療效與安全性),不須完成全部的療效性臨床試驗證明,即可申請新藥查驗登記並進入審批程序,以縮短新成份新藥的研發時程,使得藥物可提早上市。。
當然,獲得上市許可的公司仍須對該藥物持續進行研究追蹤,以便證實此藥品的療效仍然存在。如果繼續研究,試驗結果不能證實最初的效果,TFDA 將會撤銷該新藥上市核准案。
孤兒藥或罕見疾病用藥(Orphan drugs):
罕見疾病是指非常少見的疾病,大多與遺傳相關。各國對罕見疾病的定義不同,例如:台灣為罹患率在萬分之1以下,而美國則定義為國內罹病人數少於20萬人。
由於孤兒藥的市場需求太小,以利潤導向的藥廠自然對開發此類藥品不感興趣。而罕見疾病是高度未被滿足醫療需求的疾病,為了鼓勵開發商投入資源開發此類藥物,各國在社會福利方面多有規定該類藥物的開發商可以享有一系列的優惠政策。政府為了照顧這些病人,以相當的誘因來鼓勵藥廠研發孤兒藥,例如:在台灣政府施以減免稅金的優惠,並且規定孤兒藥品核准後十年內不核淮第二個同類藥物上市(專屬特賣),以相對保障產業權益。
美國政府自從1983年通過「孤兒藥品法案(ODA)」以來,已經核准了357種用來治療罕見疾病的藥物,還在作業當中的尚有2100多種。在ODA通過之前,市面上只有10種孤兒藥。美國政府通過ODA是要鼓勵製藥公司,為全美不到20萬名的罕見疾病患者開發治療方法。台灣自2000年公佈施行罕藥法後,使我國成為全球繼美國、日本、澳洲、歐盟後,第五個以公權力保障罕病醫療弱勢的國家。

美國促進嚴重疾病藥物審查計畫
與台灣設立「優先審查」、「加速審查作業(Accelerated approval)」宗旨相似,在美國,訂定促進嚴重疾病藥物審查計畫,主要目標是加速廠商開發用於以現行治療卻尚未被滿足的嚴重疾病之藥物。方法有四種,分別是快速通道 (Fast Track)、突破性治療(Breakthrough Therapy)、加速核准(Accelerated Approval)及優先審查 (Priority Review)。此四個不同的機制來自於不同的法源,審核標準、目的、申請時機以及FDA給的待遇皆不相同。

近年來因為法規要求日益嚴格與用藥安全意識提高,使得新藥開發上市困難度逐漸上升。加上常見疾病領域之治療藥物競爭逐漸激烈,各藥廠開始運用不同的開發策略,例如尋找新使用途徑、老藥新用,及搶攻罕藥市場。
對台灣新藥開發公司而言,在資源有限下,因孤兒藥品的種種優勢,孤兒藥成為適合台灣新藥開發的選項之一!有些新藥研發公司的策略,走孤兒藥的法規捷徑,再繼續研發其他適應症的治療可能性,進入市場後再透過新增孤兒藥適應症增加市場獨佔銷售時間,由此,可進而增加在國際行銷市場佈局、併購、策略聯盟的有力籌碼。



















